Dieses Protein weckt schlafende Eizellen auf und entscheidet, ob eine Frau fruchtbar bleibt – oder früh in die Menopause geht
Eizellen können jahrzehntelang ruhen, ohne ihre Funktion zu verlieren. Ein winziges Protein steuert diesen Prozess und spielt auch bei früher Menopause eine Rolle.
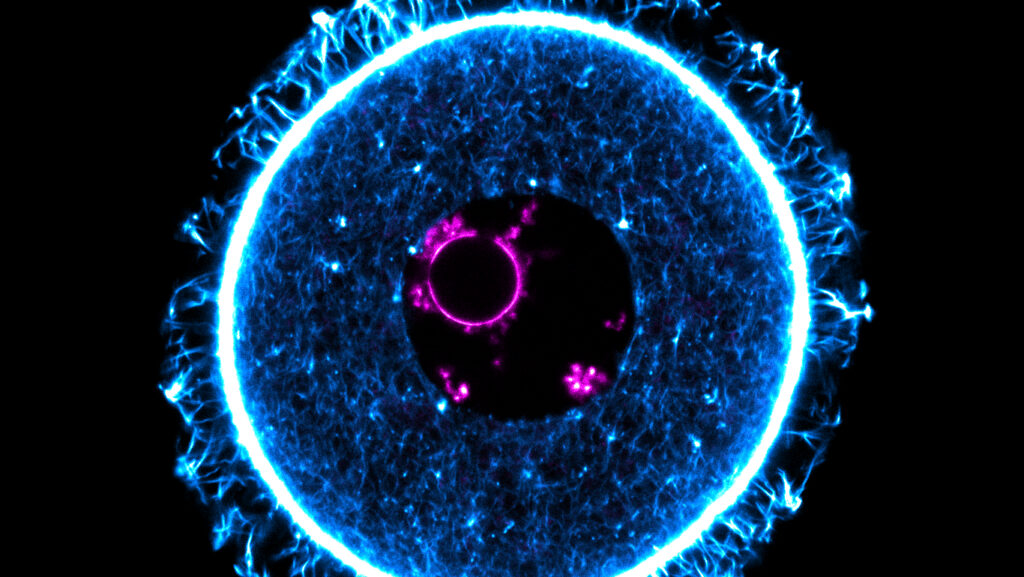
Die Eizelle einer Maus im Ruhezustand unter dem Fluoreszenzmikroskop: Die Forscher untersuchen daran, wie das Protein 4E-T die Fruchtbarkeit schützt. © Melina Schuh, Max Planck Institute for Multidisciplinary Sciences
Frauen kommen mit einer festen Anzahl an Eizellen auf die Welt. Doch diese Zellen reifen nicht sofort, sondern verharren oft jahrzehntelang in einem biologischen Stillstand – bis der Körper sie zum Eisprung freigibt. Dieser ungewöhnlich lange Ruhezustand macht Eizellen einzigartig im menschlichen Körper. Während andere Zellen altern oder sich laufend erneuern, bleiben sie erstaunlich stabil. Erst wenn ein Reifungssignal kommt, wachen sie auf – bereit für eine mögliche Befruchtung. Wie diese Wartephase über Jahrzehnte erhalten bleibt, war lange ein Rätsel.
Nun haben Forscher der Universität Konstanz einen zentralen Mechanismus entschlüsselt: Ein bestimmtes Protein steuert, wie lange Eizellen inaktiv bleiben – und wann sie mit der Reifung beginnen. Diese Erkenntnis ist nicht nur ein Durchbruch für die Zellbiologie – sie könnte auch die Reproduktionsmedizin revolutionieren.
Wie das Protein 4E-T über Eizellen wacht
Im Mittelpunkt der Studie steht das Protein 4E-T. Es wirkt wie ein Wächter, der dafür sorgt, dass Eizellen nicht zu früh reifen. Genauer gesagt: Es unterdrückt die Umsetzung bestimmter Erbinformationen in Proteinen – ein Vorgang, der normalerweise für Zellwachstum und Teilung notwendig ist. So bleiben die Eizellen im sogenannten Prophase-Stadium der Meiose, einem jahrzehntelangen Schlafzustand.
Wie entscheidend diese Funktion ist, zeigte sich in gezielten Experimenten mit Eizellen von Fröschen und Mäusen: Sobald die Forscher das Protein 4E-T aus diesen Zellen entfernten oder stark reduzierten, setzte der Reifungsprozess spontan ein – die Eizellen „wachten“ auf, lange bevor es biologisch vorgesehen war. Dieser Kontrollverlust kann dazu führen, dass die Eizellreserve zu früh erschöpft wird – mit Folgen für die Fruchtbarkeit.
Was hinter dem frühen Verlust der Fruchtbarkeit stecken könnte
Einige Frauen verlieren ihre Fruchtbarkeit schon deutlich vor dem 40. Lebensjahr. Experten sprechen dann von einer vorzeitigen Ovarialinsuffizienz. Die Konstanzer Studie liefert dafür eine potenzielle Erklärung: Mutationen im Gen für das Protein 4E-T könnten den natürlichen Reifungsstopp außer Kraft setzen.
Das bedeutet: Frauen mit bestimmten Genvarianten könnten ein erhöhtes Risiko für einen frühen Verlust ihrer Fruchtbarkeit haben. Möglicherweise helfen genetische Tests in Zukunft, dieses Risiko frühzeitig zu erkennen – und Kinderwunsch-Behandlungen gezielter zu planen.
Hoffnung für Frauen mit Kinderwunsch
Immer mehr Frauen entscheiden sich heute dafür, Eizellen für eine spätere Schwangerschaft einzufrieren. Doch nicht immer ist klar, wie lange die Zellen tatsächlich lebensfähig bleiben – oder wie sie zum richtigen Zeitpunkt zur Reifung gebracht werden können.
Wenn sich der 4E-T-Mechanismus gezielt steuern ließe, könnten Mediziner den natürlichen Ruhemodus verlängern – oder ihn bei Bedarf gezielt beenden. Das würde neue Möglichkeiten schaffen: etwa bei der künstlichen Befruchtung oder bei der Erhaltung der Fruchtbarkeit bei Krebstherapien. Für Paare mit Kinderwunsch wäre das ein echter Fortschritt.
Wie Eizellen ohne Genaktivität überleben
Die Studie liefert auch grundlegende Erkenntnisse zur Zellbiologie. Eizellen brauchen keine ständige Genaktivität, um stabil zu bleiben. Sie enthalten einen Vorrat an Boten-RNAs, also abgeschriebene Kopien der Erbinformation, die bei Bedarf aktiviert werden.
Das unterscheidet sie von den meisten anderen Zellen im Körper, die laufend Proteine bilden und sich teilen. Dass Eizellen mit so wenig Aktivität über Jahrzehnte bestehen, ist ein biologischer Sonderfall – und macht sie auch für andere Forschungsbereiche interessant, etwa in der Stammzell- oder Krebsforschung.
4E-T als Ziel für neue Therapien
Weil 4E-T eine so zentrale Rolle spielt, rückt es zunehmend in den Fokus der Medikamentenentwicklung. Wer den Reifungsstopp gezielt beeinflussen kann, könnte:
- Kinderwunsch-Behandlungen individuell steuern
- Eizellen besser konservieren und gezielt aktivieren
- neue Therapien gegen vorzeitige Menopause entwickeln
Forschungsgruppen untersuchen bereits, wie genau 4E-T funktioniert – und welche Rolle ein zweites Protein namens PATL2 spielt, das eng mit ihm zusammenarbeitet. Gemeinsam bilden sie ein Netzwerk, das darüber entscheidet, ob eine Eizelle weiter „schläft“ – oder sich auf die Reifung vorbereitet.
Kurz zusammengefasst:
- Eizellen bleiben jahrzehntelang in einem Ruhezustand, weil das Protein 4E-T gezielt verhindert, dass sie zu früh reifen.
- Mutationen im 4E-T-Gen können dazu führen, dass Eizellen unkontrolliert aktiv werden – ein möglicher Grund für eine vorzeitige Menopause.
- Das Verständnis dieses Mechanismus eröffnet neue Chancen für Fruchtbarkeitsdiagnostik, Eizellenkonservierung und gezielte Therapien in der Reproduktionsmedizin.
Übrigens: Direkt nach der Befruchtung beginnt im Embryo ein hochkomplexer Umbauprozess, der über Gesundheit und Entwicklung entscheidet. Wie der Zellkern dabei seine Ordnung selbst organisiert und Fehler eigenständig ausgleicht – mehr dazu in unserem Artikel.
Bild: © Melina Schuh, Max Planck Institute for Multidisciplinary Sciences











1 Gedanken zu „Dieses Protein weckt schlafende Eizellen auf und entscheidet, ob eine Frau fruchtbar bleibt – oder früh in die Menopause geht“