Ein Enzym stoppt die Immuntherapie bei Krebs – deshalb versagen viele Behandlungen
Die Immuntherapie gilt als Hoffnung bei Krebs, doch häufig schlägt sie nicht an. Forscher identifizieren ein Enzym als möglichen Grund.
Im Tumorgewebe greifen Immunzellen Krebszellen an, doch ein spezielles Enzym bremst ihre Wirkung aus. Neue Wirkstoffe setzen genau an dieser Blockade an und sollen die Immuntherapie wirksamer machen. (Symbolbild) © Freepik
In der Krebsmedizin haben sich die Behandlungsmöglichkeiten in den vergangenen Jahren deutlich erweitert. Dazu zählen Therapien, die gezielt das Immunsystem einbeziehen. Die Immuntherapie gegen Krebs soll Abwehrzellen in die Lage versetzen, Tumoren selbst zu erkennen und anzugreifen. Bei einem Teil der Patienten funktioniert das gut. Bei vielen bleibt der Effekt jedoch begrenzt. Entweder zeigt die Behandlung keine Wirkung oder sie lässt nach kurzer Zeit wieder nach.
Eine neue Studie liefert nun eine mögliche Erklärung. Demnach liegt das Problem oft nicht an zu schwachen Medikamenten. Tumoren verändern ihr unmittelbares Umfeld und schwächen die körpereigene Abwehr gezielt. Eine entscheidende Rolle spielt dabei ein Enzym, das Immunzellen einen wichtigen Nährstoff entzieht. Die Ergebnisse erklären, weshalb frühere Therapien hinter den Erwartungen zurückblieben und warum ein anderer Ansatz sinnvoll sein könnte. An der Arbeit war unter anderem das Max-Planck-Institut für molekulare Physiologie beteiligt.
Immuntherapie bei Krebs scheitert oft im Tumorumfeld
Die Grundidee der modernen Immuntherapie ist vergleichsweise klar. Bestimmte Bremsen an Abwehrzellen werden gelöst, damit sogenannte T-Zellen Tumorzellen wieder angreifen können. Bei einigen Krebsarten hat dieses Prinzip deutliche Fortschritte gebracht. Dennoch profitieren nur bestimmte Patientengruppen. Häufig entscheidet das direkte Umfeld des Tumors über Erfolg oder Misserfolg.
Krebszellen schaffen dort Bedingungen, die Immunzellen ausbremsen. Sie setzen Stoffwechselprodukte frei, die Abwehrreaktionen dämpfen. Besonders wichtig ist dabei das Enzym IDO1. Es baut die Aminosäure Tryptophan ab. Für T-Zellen ist diese Substanz unverzichtbar. Fehlt sie, verlieren die Zellen an Energie und Durchsetzungskraft.
IDO1 schützt den Körper – und später den Tumor
Im gesunden Körper erfüllt IDO1 eine sinnvolle Aufgabe. Es verhindert überschießende Immunreaktionen und schützt so vor Autoimmunerkrankungen. Im Tumorgewebe kippt diese Schutzfunktion. Krebszellen produzieren das Enzym in großen Mengen. Dadurch entsteht ein lokaler Zustand, in dem Immunzellen kaum noch aktiv bleiben.
Frühere Medikamente zielten auf diesen Mechanismus. Sie sollten IDO1 blockieren. In Laborversuchen sah dieser Ansatz vielversprechend aus. In großen klinischen Studien zeigte sich jedoch kein zusätzlicher Nutzen für Patienten. Teilweise verschlechterte sich die Wirkung sogar.
Inzwischen gilt als wahrscheinlich, dass IDO1 seine hemmende Wirkung nicht nur über seine enzymatische Aktivität entfaltet. Schon die bloße Anwesenheit des Proteins reicht offenbar aus, um Abwehrreaktionen zu schwächen. Wird das Enzym lediglich blockiert, bleibt dieser Effekt bestehen.
Ein neuer Schritt für die Immuntherapie bei Krebs
Hier setzt der neue Ansatz an. Statt IDO1 zu hemmen, wird das Enzym gezielt entfernt. Die Forscher entwickelten Substanzen, die IDO1 für den Abbau markieren. Die Zelle erkennt das Protein dann als überflüssig und entsorgt es über ihre eigene Abbaumaschinerie.
Dabei nutzt der Ansatz einen natürlichen Vorgang. Proteine, die mit dem kleinen Molekül Ubiquitin markiert sind, werden in der Zelle zerlegt. Die neuen Wirkstoffe verändern die räumliche Struktur von IDO1 so, dass dieses Signal ausgelöst wird. Das Enzym verschwindet vollständig aus der Zelle.
Mehr Energie für T-Zellen im Tumor
Sinkt die Menge von IDO1, verändert sich auch der Stoffwechsel im Tumorumfeld. Tryptophan steht wieder zur Verfügung. Gleichzeitig nimmt die Konzentration des immundämpfenden Abbauprodukts Kynurenin ab. T-Zellen gewinnen dadurch an Aktivität zurück.
In präklinischen Versuchen ließ sich dieser Effekt gut beobachten. In Zellkulturen reagierten Immunzellen wieder deutlich stärker. Auch im Tiermodell verlangsamte sich das Tumorwachstum. Mäuse mit bestimmten Ovarialtumoren lebten länger, wenn das Enzym konsequent abgebaut wurde.
Studienleiter Herbert Waldmann ordnet die Ergebnisse vorsichtig ein: „Die von uns identifizierten IDO1-Hemmstoffe zeigen eine einzigartige Wirkweise. Sie führen zum Abbau von IDO1 und könnten damit die Probleme der bisherigen IDO1-Hemmung lösen.“
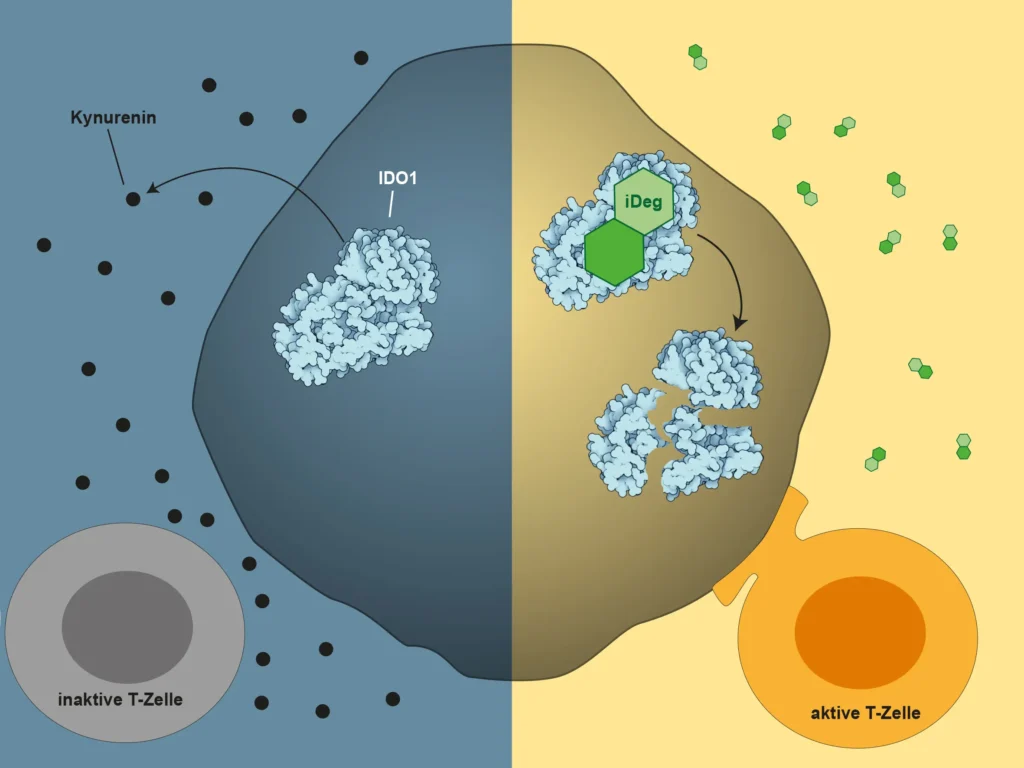
Möglicher Grund für gescheiterte Immuntherapie bei Krebs
Die neuen Erkenntnisse erklären möglicherweise gescheiterte klinische Studien der vergangenen Jahre. Dort hatte man IDO1 blockiert, ohne das Protein selbst zu beseitigen. In einigen Fällen stieg die Menge des Enzyms sogar an, was die Schutzmechanismen des Tumors ungewollt verstärkt haben könnte.
Damit wird verständlich, warum hohe Erwartungen nicht erfüllt wurden. Die Wechselwirkung zwischen Tumor und Immunsystem ist komplex. Schon kleine molekulare Details können über Erfolg oder Misserfolg ganzer Therapiekonzepte entscheiden.
Was die neuen Erkenntnisse für die Krebsforschung bedeuten
Bislang handelt es sich um präklinische Ergebnisse. Studien am Menschen stehen noch aus. Dennoch ist der Erkenntnisgewinn groß. Der Ansatz verschiebt den Blick weg von reiner Blockade hin zur gezielten Entfernung schädlicher Proteine. Für die weitere Entwicklung zeichnen sich mehrere Möglichkeiten ab:
- Kombinationen mit bestehenden Immuntherapien könnten gezielter wirken
- Resistenzen gegen Checkpoint-Hemmer ließen sich möglicherweise überwinden
- Auch bei virusbedingten Tumoren könnte der Ansatz relevant sein
Das Interesse an IDO1 bleibt entsprechend hoch. Weltweit laufen mehrere klinische Studien zu neuen Modulatoren dieses Enzyms.
Kurz zusammengefasst:
- Viele Immuntherapien gegen Krebs wirken nicht dauerhaft, weil Tumoren ihr Umfeld gezielt so verändern, dass Abwehrzellen geschwächt werden. Ein zentrales Enzym namens IDO1 entzieht T-Zellen eine wichtige Nährstoffgrundlage und bremst ihre Aktivität.
- Frühere Medikamente blockierten IDO1 zwar, ließen es aber im Körper bestehen und konnten die Immunhemmung dadurch sogar verstärken. Die bloße Anwesenheit des Enzyms reicht offenbar aus, um die Immunabwehr zu dämpfen.
- Ein neuer Ansatz setzt deshalb auf den vollständigen Abbau von IDO1. In präklinischen Versuchen wurde das Immunsystem dadurch wieder aktiver, Tumoren wuchsen langsamer und Tiere lebten länger.
Übrigens: Beim kleinzelligen Lungenkrebs entscheidet sich die Aggressivität oft schon, bevor ein Tumor überhaupt sichtbar ist – eine stille Entzündung programmiert das Immunsystem frühzeitig auf Schwäche und begünstigt spätere Rückfälle. Warum dieser frühe Kipppunkt die Krankheit so gefährlich macht, mehr dazu in unserem Artikel.
Bild: © Freepik