Forscher filmen erstmals, wie Fett durch Zellen fließt – und bei Alzheimer aus dem Gleichgewicht gerät
Der Lipidtransport in der Zelle verläuft gezielter und schneller als gedacht – das verändert den Blick auf Krankheiten wie Alzheimer und Fettleber.
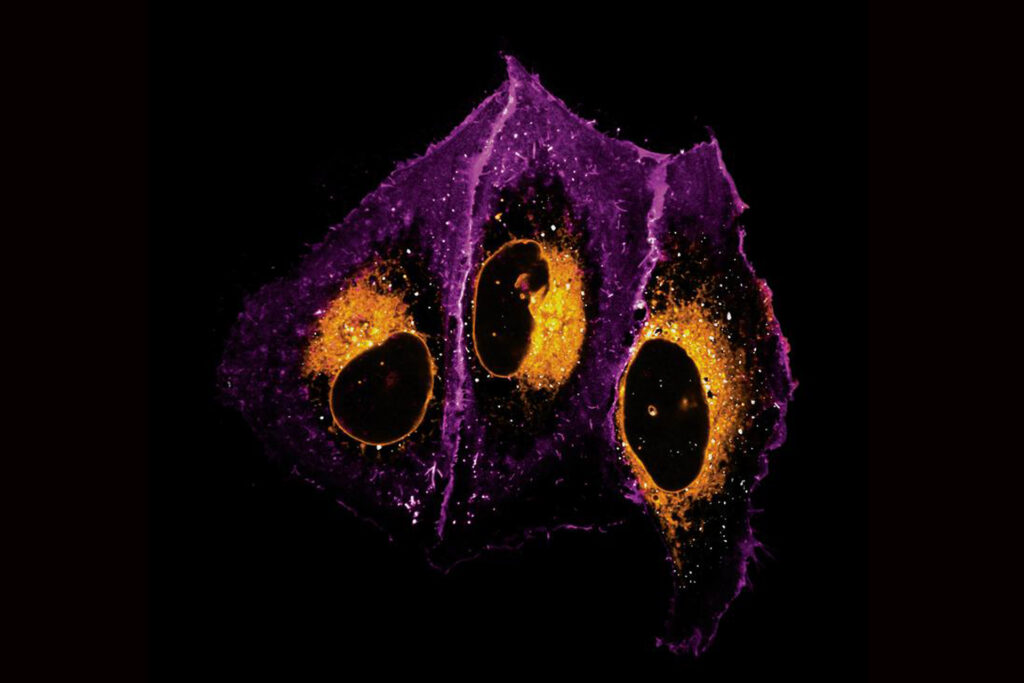
Die Aufnahme zeigt eine menschliche Knochenzelle (U2OS) unter dem Mikroskop: Das Lipid leuchtet orange, die Zellmembran ist lila, die Endosomen sind weiß. Sie veranschaulicht, wie gezielt der Lipidtransport in der Zelle abläuft – nicht über Vesikel, sondern über spezielle Transportproteine. © Kristin Böhlig und Juan Iglesias-Artola / Nature (2025) / MPI-CBG
Fette haben ein Imageproblem. Dabei steuern sie unbemerkt viele zentrale Prozesse im Körper – sogar in jeder einzelnen Zelle. Dort helfen sie, Energie zu speichern, Zellhüllen zu bilden und lebenswichtige Signale weiterzugeben. Entscheidend ist jedoch, dass diese Fettmoleküle am richtigen Ort aktiv werden. Gerät der innerzelluläre Transport aus dem Takt, kann das schwerwiegende Folgen haben: von Stoffwechselkrankheiten bis hin zu Alzheimer, Parkinson oder Fettleber. Doch wie genau bewegen sich Fette überhaupt durch den engen Raum der Zelle? Und was passiert, wenn dieser Weg gestört ist?
Ein Forschungsteam aus Dresden hat nun ein Verfahren entwickelt, mit dem sich zum ersten Mal genau beobachten lässt, wie sich Fette in lebenden Zellen bewegen – schnell, gezielt und bis hinunter auf die Ebene einzelner Moleküle.
Forscher machen Fetttransport in lebenden Zellen sichtbar
In Zusammenarbeit mit Partnern aus Prag und Leipzig haben Wissenschaftler des Max-Planck-Instituts für molekulare Zellbiologie und Genetik eine bildgebende Methode entwickelt, die den Fettfluss innerhalb der Zelle sichtbar macht. Bisher war das kaum möglich: Fette lassen sich – anders als etwa Eiweiße oder Erbgut – nur schwer sichtbar machen und im Mikroskop erkennen.
Nun gelang es erstmals, den Weg einzelner Lipide in Echtzeit nachzuvollziehen – etwa von der äußeren Zellmembran zu den Mitochondrien oder anderen Organellen. Die Forscher setzen dafür spezielle chemische Markierungen ein, die die Fettmoleküle sichtbar machen, ohne ihre Funktion zu stören.
Fette nehmen direkten Weg – nicht in Bläschen, sondern Protein-gestützt
Das Überraschende: Die meisten Fette werden nicht – wie bisher angenommen – in kleinen Transportbläschen (Vesikeln) durch die Zelle geschleust. Stattdessen wandern sie auf direktem Weg – mithilfe spezieller Transportproteine. Dieser Mechanismus galt bisher als Ausnahmefall. Doch die neue Studie zeigt: Bis zu 95 Prozent aller Lipide nehmen diesen schnelleren und gezielteren Weg.
„Wir haben herausgefunden, dass der Transport ohne Vesikel sowohl schneller als auch zielgerichteter verläuft“, schreiben die Studienautoren.
Ein Paradigmenwechsel in der Zellbiologie – mit weitreichenden Folgen für die medizinische Forschung.
PE ist der schnellste Lipidtyp – Struktur beeinflusst Geschwindigkeit
Die Forscher analysierten verschiedene Fettarten, darunter:
- Phosphatidylethanolamin (PE)
- Phosphatidylcholin (PC)
- Sphingomyelin (SM)
Dabei zeigten sich klare Unterschiede:
- PE wird am schnellsten transportiert, gefolgt von PC und SM.
- Polyungesättigte PC-Moleküle bewegen sich bis zu siebenmal schneller als gesättigte.
- Ist die Fettsäure an einer bestimmten Stelle im Molekül gebunden (sn-2 statt sn-1), verdoppelt sich die Geschwindigkeit.
- Insgesamt läuft der Transport zehn- bis sechzigmal schneller ab als der eigentliche Fettstoffwechsel.
Die Ergebnisse belegen: Nicht der Umbau eines Lipids ist entscheidend – sondern, wie es bewegt wird.
Veränderte Fettwege bei Fettleber und neurodegenerativen Erkrankungen
Störungen im innerzellulären Fetttransport werden mit einer Vielzahl von Erkrankungen in Verbindung gebracht, etwa:
- Nicht-alkoholische Fettleber
- Neurodegenerative Krankheiten wie Alzheimer und Parkinson
- Autoimmun- und Stoffwechselerkrankungen
Mit dem neuen Verfahren lassen sich diese Störungen präzise untersuchen. Die Forscher können beobachten, welche Transportproteine betroffen sind – und wo der Fettfluss ins Stocken gerät.
„Unsere Lipid-Bildgebungstechnik ermöglicht erstmals die mechanistische Analyse des Lipidtransports direkt in lebenden Zellen“, erklärt Studienleiter Prof. Alf Honigmann von der TU Dresden.
Ohne Transportproteine bleibt das Fett stecken
In Experimenten schaltete das Team gezielt zentrale Transportproteine aus – mit deutlichen Folgen:
- Fehlt das Protein CPTP, das Sphingomyelin transportiert, sinkt der Fettfluss auf 57 Prozent.
- Wird das Flippase-Protein TMEM30A blockiert, das PE-Fette in die innere Zellmembran verschiebt, verlangsamt sich der Transport um das Dreifache.
Ohne die passenden Proteine kommt der Lipidfluss also fast zum Erliegen – mit potenziell krankmachenden Konsequenzen.
Wie die Zelle entscheidet, was mit dem Fett passiert
Die Forscher analysierten nicht nur den Weg der Lipide innerhalb der Zelle, sondern auch ihr Schicksal nach dem Transport. Je nach chemischem Aufbau wurden die Fettmoleküle entweder weiterverarbeitet oder dauerhaft gespeichert. Dabei zeigte sich: Schon minimale strukturelle Unterschiede entscheiden über das weitere Schicksal des Lipids.
Lipide, bei denen die Fettsäure an der sogenannten sn-1-Position des Moleküls sitzt, landen doppelt so häufig in Fettspeichern wie solche mit einer sn-2-Position. Außerdem werden sn-1-Lipide bis zu siebenmal häufiger in Cholesterinester umgewandelt – eine Speicherform von Cholesterin, die in verschiedenen Organellen gelagert wird.
Für die Forschung bedeutet das: Wer den genauen Aufbau eines Lipids kennt, kann künftig besser vorhersagen, wie es sich im Zellinneren verhält – und welche Funktion es erfüllt. Krankhafte Fettablagerungen können damit besser verstanden und untersucht sowie gezielt beeinflusst werden – etwa bei Fettleber, Arteriosklerose oder Stoffwechselstörungen.
Kurz zusammengefasst:
- Forscher aus Dresden haben ein Verfahren entwickelt, mit dem sich der Lipidtransport in der Zelle erstmals direkt und präzise beobachten lässt.
- Sie zeigen, dass Fette nicht über Vesikel, sondern gezielt über Transportproteine bewegt werden – deutlich schneller und spezifischer als bisher gedacht.
- Die Methode hilft zu verstehen, wie Fettverteilung in der Zelle mit Krankheiten wie Alzheimer oder Fettleber zusammenhängt und eröffnet neue Wege für Diagnose und Therapie.
Übrigens: Noch bevor eine Eizelle überhaupt reift, wacht ein bestimmtes Protein darüber, dass sie jahrzehntelang im Ruhezustand bleibt. Wie dieser molekulare Wächter über Fruchtbarkeit und Menopause entscheidet – mehr dazu in unserem Artikel.
Bild: © Kristin Böhlig und Juan Iglesias-Artola / Nature (2025) / MPI-CBG