Polyamin-Trick: Mainzer Forscher schalten Krebs-Tarnsystem im Labor aus
Mainzer Studie zeigt: Blockiert man bestimmte Moleküle im Tumor, werden Abwehrzellen reaktiviert und Krebszellen gezielt bekämpft.
Polyamine im Tumor blockieren Abwehrzellen und verhindern so eine wirksame Krebsbekämpfung. © DALL-E
Krebszellen sind Meister der Tarnung. Sie verändern ihre Umgebung so, dass das Immunsystem sie nicht mehr als Gefahr erkennt. Jetzt haben Wissenschaftler der Universitätsmedizin Mainz einen molekularen Mechanismus entschlüsselt, der diese Tarnung möglich macht – und zeigen, wie sich der Effekt umkehren lässt. Das eröffnet neue Chancen für Therapien, die das körpereigene Abwehrsystem gezielt gegen Tumore einsetzen.
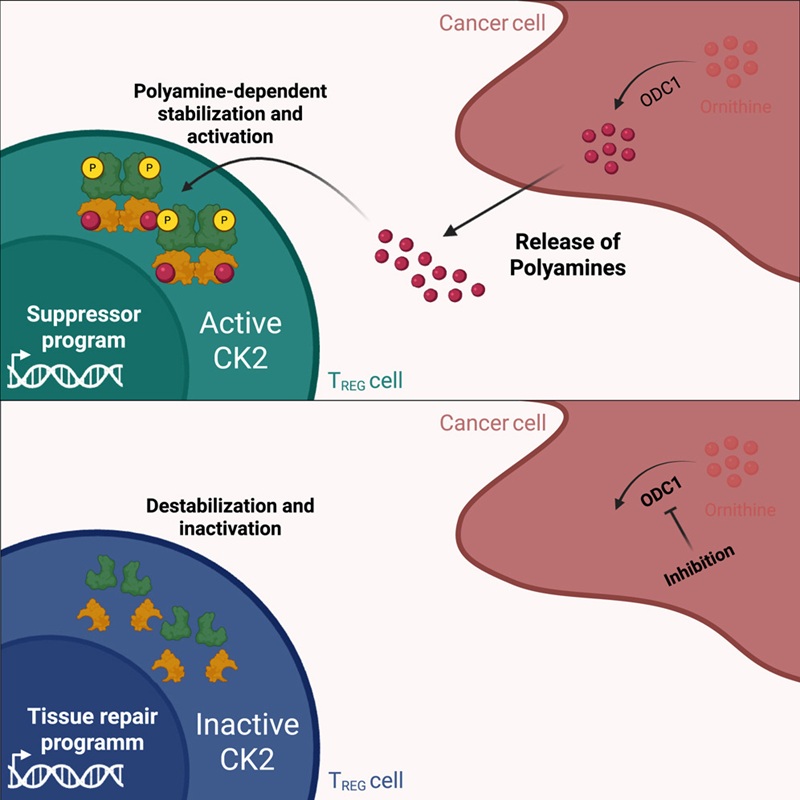
Im Mittelpunkt der Studie stehen Polyamine – winzige Moleküle, die Tumorzellen in großen Mengen herstellen. Sie steuern das Verhalten bestimmter Immunzellen und bringen sie dazu, den Tumor eher zu schützen als zu bekämpfen. Gelingt es, diese Moleküle zu blockieren, verändert sich das Immunsystem dramatisch: Abwehrzellen werden aktiv, das Tumorgewebe besser durchblutet und Medikamente können leichter eindringen.
Wie Polyamine das Immunsystem austricksen und Krebs verstecken
Eine besondere Rolle spielen regulatorische T-Zellen, kurz Treg-Zellen. Sie sorgen normalerweise dafür, dass Abwehrreaktionen nicht über das Ziel hinausschießen – wichtig, um Autoimmunerkrankungen zu verhindern. Tumore machen sich genau diesen Schutzmechanismus zunutze.
Polyamine, die im Tumorgewebe entstehen, programmieren Treg-Zellen so um, dass diese eine wirksame Krebsabwehr unterdrücken. Das Ergebnis: Killer-T-Zellen, die den Tumor zerstören könnten, werden ausgebremst.
„Polyamine im Tumor steuern die Entwicklung von Treg-Zellen zu einer Form, die effektive Abwehrreaktionen gegen Tumore verhindert“, sagt Studienleiter Tobias Bopp.
Blockade der Polyamine schaltet Abwehr wieder frei
Die Mainzer Forscher testeten, was passiert, wenn man die Produktion von Polyaminen im Tumor hemmt – etwa mit dem Wirkstoff DFMO. Die Wirkung war eindeutig: Die Treg-Zellen nahmen neue Aufgaben an. Statt die Abwehr zu bremsen, unterstützten sie eine sogenannte Typ-2-Immunantwort.
Diese Reaktionsform aktiviert Killer-T-Zellen, steigert die Bildung neuer Blutgefäße im Tumor und verbessert die Sauerstoffversorgung. Das Gewebe wird durchlässiger – ein Vorteil für alle Medikamente, die den Tumor erreichen müssen.
Mehr Sauerstoff, bessere Medikamentenwirkung
In Tiermodellen führte diese Umprogrammierung zu kleineren Tumoren und einem fitteren Immunsystem. Die Tumore waren besser durchblutet und wiesen weniger sauerstoffarme Bereiche auf. Das könnte nicht nur das Immunsystem stärken, sondern auch die Wirksamkeit klassischer Therapien erhöhen – von Chemotherapie bis zu modernen Antikörperbehandlungen.
„Polyamin-Blockade führt dazu, dass Treg-Zellen ein Gewebe-Reparaturprogramm aktivieren und so eine effiziente antitumorale Typ-2-Immunantwort auslösen“, heißt es in der Studie.
Patientendaten stützen Zusammenhang zwischen Polyaminen und Krebsabwehr
Dass dieser Mechanismus nicht nur im Tiermodell funktioniert, zeigen Auswertungen von Gewebeproben von Melanom-Patienten. Menschen mit niedrigen Werten eines bestimmten Enzyms (CSNK2B), das für die Polyamin-Wirkung wichtig ist, hatten eine bessere Überlebenschance. Gleiches galt für Patienten mit hohen Werten des ILT3-Gens, das in den umprogrammierten Treg-Zellen vermehrt aktiv ist.
Die Hemmung der Polyamin-Produktion könnte künftig in mehreren Bereichen eine Rolle spielen:
- Direkt als neue Therapie: Tumore würden dadurch angreifbarer für das Immunsystem.
- In Kombination mit bestehenden Immuntherapien: Die Blockade könnte verhindern, dass Abwehrzellen ermüden oder blockiert werden.
- Als Verstärker für andere Medikamente: Bessere Durchblutung und höhere Durchlässigkeit des Tumorgewebes könnten Chemotherapeutika oder Antikörpertherapien wirksamer machen.
Klinische Studien bereits gestartet
In den USA läuft derzeit eine erste klinische Studie mit einer Kombination aus DFMO und dem Transporthemmer AMXT 1501. Ziel ist es zu prüfen, ob sich der positive Effekt aus den Tierexperimenten auch beim Menschen wiederholen lässt. In den bisherigen Tests stieg der Anteil der günstigen ILT3+ Treg-Zellen im Tumor deutlich an, und das Tumorwachstum verlangsamte sich.
Sollte sich der Ansatz bewähren, könnten künftig mehr Krebspatienten von Immuntherapien profitieren – auch jene, bei denen bisherige Methoden versagen. Zudem könnte eine verbesserte Medikamentenwirkung bedeuten, dass Behandlungen kürzer dauern und weniger Nebenwirkungen verursachen. Das würde die Lebensqualität erhöhen und die Kosten im Gesundheitssystem senken.
Warum der Mechanismus so wichtig ist
Krebs ist weltweit eine der häufigsten Todesursachen. Jede Methode, die das Immunsystem gezielt stärken kann, hat potenziell enorme Auswirkungen. Die gezielte Beeinflussung von Polyaminen ist besonders interessant, weil sie die Balance des Immunsystems nicht zerstört: Der Schutz vor Autoimmunreaktionen bleibt erhalten, während die Krebsabwehr gleichzeitig gestärkt wird.
Kurz zusammengefasst:
- Polyamine sind Moleküle, die Tumorzellen in großer Menge produzieren und damit bestimmte Immunzellen so beeinflussen, dass sie die Krebsabwehr unterdrücken.
- Wird die Polyamin-Produktion blockiert, wandeln sich diese Zellen in eine Form um, die Gewebe repariert, Killer-T-Zellen unterstützt und den Tumor angreifbarer macht.
- In Tiermodellen führte das zu kleineren Tumoren; Patientendaten deuten darauf hin, dass dieser Mechanismus auch beim Menschen wirksam sein könnte.
Übrigens: Ein neuer mRNA-Impfstoff weckt Abwehrzellen so effektiv, dass selbst bislang therapieresistente Krebsarten im Labor angreifbar wurden – mehr dazu in unserem Artikel.
Bild: © DALL-E via Wikimedia unter CC BY-SA 4.0