ChatGPT für die Medikamentenentwicklung – KI soll Therapien beschleunigen
Ein neues KI-Modell zeigt, wie Viren und Alzheimer im Körper wirken – und könnte die Medikamentenentwicklung deutlich beschleunigen.
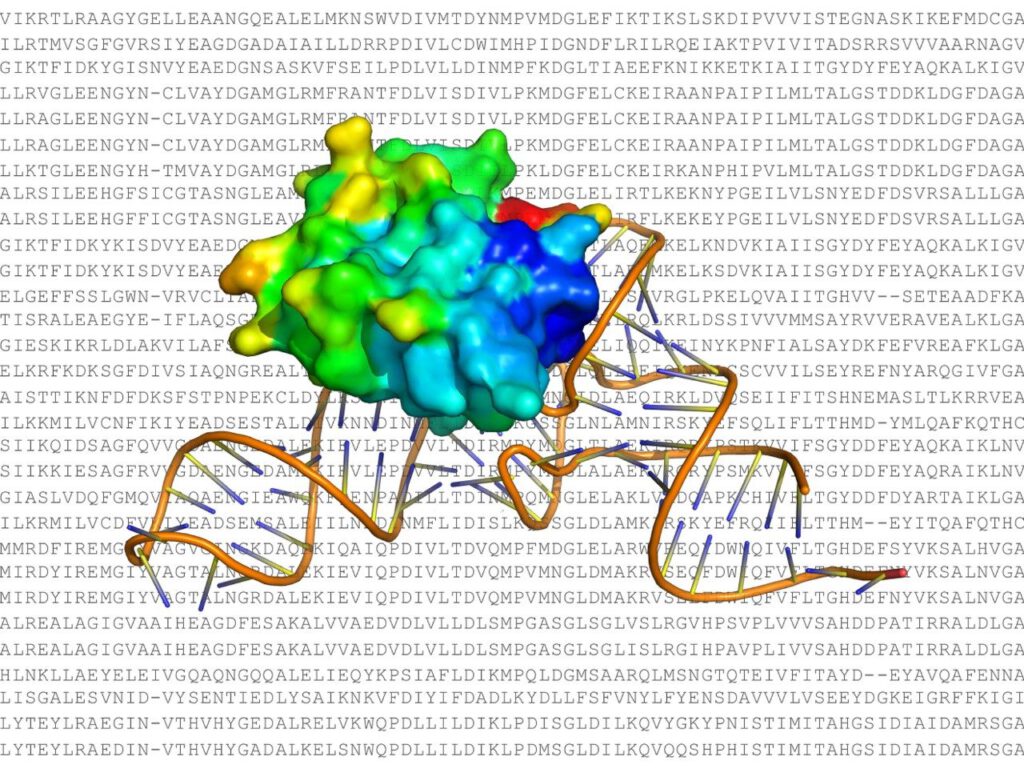
3D-Darstellung: So zeigt das ProRNA3D-single-Tool, wie virale RNA an menschliche Proteine bindet. © Virginia Tech
Die Suche nach neuen Medikamenten ist oft ein Wettlauf gegen die Zeit. Je länger es dauert, eine Krankheit zu verstehen, desto mehr Menschen verlieren wertvolle Lebensjahre. Die Corona-Pandemie hat das eindrücklich gezeigt: Bevor ein Impfstoff verfügbar war, starben Millionen Menschen. Auch bei Alzheimer steigt der Druck. Die Krankheit greift Gedächtnis und Persönlichkeit an – wirksame Therapien fehlen weitgehend.
Ein neues Werkzeug aus der Informatik könnte diesen Wettlauf beschleunigen. Es verbindet künstliche Intelligenz mit modernster Biomedizin und macht sichtbar, wie Viren oder fehlgesteuerte Eiweiße im Körper arbeiten. Damit gewinnt die KI in der Medikamentenentwicklung enorm an praktischer Bedeutung.
Forscher bringen unsichtbare Prozesse ans Licht
Das Programm trägt den Namen ProRNA3D-single. Entwickelt wurde es von einem Team um den Informatiker Debswapna Bhattacharya von der Virginia Tech und veröffentlicht in der Fachzeitschrift Cell Systems. Sein Kern: Es zeigt, wie RNA-Moleküle und Proteine dreidimensionale Strukturen bilden – genau diese Strukturen bestimmen, ob ein Virus Zellen befällt oder ob sich im Gehirn Ablagerungen bilden.
„Das ultimative Ziel ist es, den Prozess der Arzneimittelentwicklung zu beschleunigen, um zu verhindern, dass RNA-Viren mit menschlichen Proteinen interagieren“, sagt Bhattacharya. So lasse sich eine Infektion schon früh blockieren oder ein krankhafter Mechanismus bei Alzheimer gezielt aufhalten.
Mit KI in der Medikamentenentwicklung schneller zu neuen Wirkstoffen
Bisher mussten Forscher mühsam und teuer im Labor testen, wie Protein-RNA-Komplexe aussehen. Selbst hochgelobte KI-Modelle wie AlphaFold 3 lieferten hier oft ungenaue Ergebnisse. AlphaFold hat zwar bewiesen, wie leistungsfähig KI bei Eiweißstrukturen sein kann – doch bei der Kombination von Proteinen mit RNA stößt es an Grenzen.
ProRNA3D-single geht weiter. Es kombiniert zwei Sprachmodelle – eines für Proteine, eines für RNA. Indem diese Modelle miteinander „sprechen“ und ihre Informationen geometrisch zueinander ausrichten, entstehen detailgetreue Bilder von Bindungsvorgängen im Körper. „Die bio LLMs sind im Prinzip wie ChatGPT, aber für biologische Sequenzen“, erklärt Bhattacharya.
Vorteil: Genauigkeit auch bei wenigen Daten
Ein zusätzlicher Pluspunkt: Das neue Modell kommt schon mit wenigen Informationen aus. Während andere Methoden riesige Datenmengen über ähnliche Moleküle benötigen, reicht ProRNA3D-single bereits eine einzelne Sequenz. Für die Forschung ist das enorm hilfreich – gerade bei neu auftretenden Viren, über die es kaum Daten gibt.
Für die Medikamentenentwicklung bedeutet das: Forscher können genau erkennen, wo ein Virus andockt, und Substanzen entwickeln, die diesen Schritt verhindern.
Pandemie-Erfahrungen verdeutlichen Nutzen
Die Corona-Krise hat gezeigt, wie entscheidend Zeit sein kann. „Wenn man sich an die Pandemie erinnert und an den mRNA-basierten Impfstoff, dann sieht man, wie wichtig RNA-Therapeutika sein können“, sagt Doktorand Sumit Tarafder. Mit exakten 3D-Modellen ließe sich noch schneller bestimmen, an welcher Stelle Medikamente wirken müssen.
Auch bei Alzheimer könnte die Methode entscheidend helfen. Forscher könnten besser nachvollziehen, wie Eiweiße ihre Form ändern, Nervenzellen schädigen und Gedächtnisverlust auslösen.
Wo die KI bei Alzheimer und Viren ansetzt:
- Viren wie SARS-CoV-2 lassen sich früh analysieren, bevor sie Pandemien auslösen.
- Bei Alzheimer könnten Medikamente präzise an den Strukturen ansetzen, die Nervenzellen zerstören.
- Neue Wirkstoffe lassen sich schneller entwickeln, weil teure Laborumwege entfallen.
Teamarbeit über zwei Jahre
Mehr als zwei Jahre arbeitete das Team an ProRNA3D-single. Einen großen Teil der Programmierung übernahm Rahmatullah Roche, der inzwischen Professor an einer US-Universität ist. Bhattacharya lobt: „Die leitenden Doktoranden haben enorme Arbeit geleistet. Sie haben den Großteil getragen.“
Unterstützt wurde das Projekt von den National Institutes of Health und der National Science Foundation. Besonders wichtig: Die Software ist frei verfügbar. Forschungsteams weltweit können sie direkt einsetzen, testen und verbessern.

Offene Forschung beschleunigt Fortschritt
„Wir glauben, dass Offenheit der Schlüssel ist, um Wissenschaft für alle zugänglich zu machen“, sagt Bhattacharya. Weil Steuergelder die Arbeit finanzieren, müsse das Ergebnis auch der Gesellschaft zugutekommen. Deshalb veröffentlichen die Forscher nicht nur ihre Ergebnisse, sondern auch den Programmcode.
So können andere Teams sofort aufbauen und schneller Medikamente entwickeln. Jeder Tag, den ein Wirkstoff früher bereitsteht, kann entscheidend sein.
Kurz zusammengefasst:
- ProRNA3D-single ist ein neues KI-Modell, das Protein-RNA-Strukturen sichtbar macht und damit die Medikamentenentwicklung gegen Viren und Alzheimer beschleunigen kann.
- Es übertrifft bestehende Systeme wie AlphaFold 3, weil es auch mit wenigen Daten arbeitet und dadurch bei neu auftretenden Erregern besonders nützlich ist.
- Die Software ist frei verfügbar, damit Forschung weltweit schneller vorankommt und neue Therapien früher bei Patienten ankommen.
Übrigens: Nicht nur neue KI-Modelle wie ProRNA3D-single beschleunigen die Arzneiforschung. Auch ein LinkedIn-Algorithmus hilft inzwischen dabei, bekannte Medikamente für ganz neue Krankheiten nutzbar zu machen – mehr dazu in unserem Artikel.
Bild: © Virginia Tech













1 -Gedanken zu “ChatGPT für die Medikamentenentwicklung – KI soll Therapien beschleunigen”